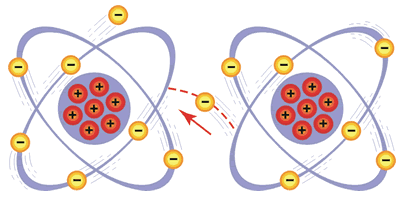
CORRENTE ELÉTRICA
Esse fluxo de elétrons ordenados é definido pela razão entre a quantidade de cargas elétricas pelo tempo. Sua unidade de medida é o ampère (A).
DIFERENÇA DE POTENCIAL ( d. d. p. )
Também denominada tensão, é a diferença de potencial elétrico armazenada entre dois pontos. Devido a esse ''desnível'' de energia, surge um fluxo de elétrons trafegando de um ponto mais energético para outro menos energético.
LEI DE COULOMB
Na prática, procura - se então usar uma unidade de carga que seja mais apropriada. No Sistema Internacional (SI) a unidade de carga elétrica é denominada 1 coulomb = 1C, em homenagem ao físico francês Charles Coulomb. Esse cientista, analisando as forças de interação entre cargas elétricas, chegou a uma importante lei.
Quando dizemos que um objeto possui uma carga de 1C, modernamente, após o estabelecimento do valor da carga fundamental, entendemos que esse objeto perdeu ou ganhou 6,25 x 1018 elétrons, isto é:
1C corresponde a 6,25 x 1018 elétrons em excesso (se a carga do objeto for negativa) ou em falta (se a carga do objeto for positiva).
Na Eletrostática, geralmente lidamos com cargas elétricas muito menores do que 1C. Nesse caso, é costume expressar os valores das cargas dos objetos eletrizados em mC = milicoulomb (1mC = 10-3 C) ou em µC = microcoulomb (1µC = 10-6 C).
Pensamento de Charles Coulomb - ''Se 1C tem 6,25 x 1018 elétrons, qual é a quantidade de carga de 1 elétron ?''
1C - 6,2510 x 1018 elétrons
q - 1 elétron
logo, q = 1,6 x 10-19 C.
Cálculo da carga elementar do elétron
RESISTÊNCIA ELÉTRICA
É a propriedade de certos materiais em dificultar a passagem de corrente elétrica. Um carro trafegando numa estrada de asfalto que precise mudar seu rumo para uma estrada de terra, esburacada e molhada, tem sua velocidade reduzida porque fica mais difícil a locomoção.
Com os materiais condutores de eletrecidade também ocorre essa situação:
metais são como estradas de asfalto em relação ao vidro ou borracha, que praticamente não permitem a passagem de corrente elétrica.
PRIMEIRA LEI DE OHM
O físico e matemático alemão Georg Simon Ohm (1787-1854), ao estudar as propriedades de diferentes materiais condutores, verificou o surgimento de uma corrente elétrica proporcional à d.d.p. aplicada, para intervalos pequenos de temperatura.
Para realizar seu experimento, usou basicamente uma pilha, diferentes condutores, um medidor de tensão (voltímetro) e outro medidor de corrente elétrica (amperímetro).
A Primeira Lei de Ohm corresponde à razão entre essas grandezas:
U = R . i
Em que:
U = d.d.p. ou tensão (V)
R = resistência elétrica (Ω - ohm)
i = corrente elétrica (A)
O MODELO ATÔMICO DE BOHR (1913)
Em 1913, o físico dinarmaquês Niels Bohr (1885-1962), Prêmio Nobel em 1922, propôs um modelo atômico explicando a estabilidade do átomo. Bohr obeteve um excelente resultado aplicando a teoria quântica do alemão Max Planck (1858-1947). Após um estudo detalhado do espectro descontínuo do átomo de hidrogênio, que tem apenas um elétron movendo-se em torno do núcleo, Bohr propôs um modelo atômico por meio dos seguintes postulados:
- o elétron descreve órbitas circulares ao redor do núcleo, cujos raios rn são dados pela expressão: rn = n2 . ε0 . h2 ⁄ π . m . Z . e2 ; ε0 = permissividade elétrica do vácuo h = constante de Planck ;
- as órbitas foram chamadas por Bohr de estados estacionários e, portanto, diz-se que o elétron está em um estado estacionário ou nível de energia em que cada órbita é caracterizada por um número quântico (n), que pode assumir valores inteiros entre 1, 2, 3, ...;
- a energia associada aos níveis de energia do hidrogênio é dada por: En = -13,60 eV ⁄ n2 , notando-se que se utiliza aqui a unidade elétron-volt (eV) - que corresponde à energia de um elétron acelerado por 1V -, conveniente para processos atômicos e mais simples que seu valor em joule (1,6 . 10-19 J);
- um elétron que permanece em dado estado estacionário não emite energia, apresentando, assim, uma energia constante;
- a passagem de um elétron de uma órbita para outra supõe absorção ou emissão de determinada quantidade de energia, conforme o elétron se move de uma posição menos energética para outra mais energética e vice-versa;
- a energia é absorvida ou liberada na forma de radiação eletromagnética e é calculada pela expressão: ΔE = h . f ou Ef - Ei = h . f ;
SÍMBOLOS DOS ELEMENTOS QUÍMICOS
Ac - Actínio
Al - Alumínio
Am - Amerício
Sb - Antimônio
Ar - Argônio
As - Arsênico
At - Astato
Ba - Bário
Be - Berílio
Bk - Berquélio
Bi - Bismuto
Bh - Bóhrio
B - Boro
Br - Bromo
Cd - Cádmio
Ca - Cálcio
Cf - Califórnio
C - Carbono
Ce - Cério
Cs - Césio
Pb - Chumbo
Cl - Cloro
Co - Cobalto
Cu - Cobre
Kr - Criptônio
Cr - Cromo
Cm - Cúrio
Dy - Disprósio
Db - Dúbnio
Es - Einstênio
S - Enxofre
Er - Érbio
Se - Escândio
Sn - Estanho
Sr - Estrôncio
Eu - Európio
Fm - Férmio
Fe - Ferro
F - Flúor
P - Fósforo
Fr - Frâncio
Gd - Gadolínio
Ga - Gálio
Ge - Germânio
Hf - Háfnio
Hn - Hâhnio
He - Hélio
H - Hidrogênio
Ho - Hólmio
In - Índio
I - Iodo
Ir - Irídio
Yb - Itérbio
Y - Ítrio
Jl - Joliôtio
La - Lantânio
Lr - Lawrêncio
Li - Lítio
Lu - Lutércio
Mg - Magnésio
Mn - Manganês
Mt - Meitnério
Md - Mendelévio
Hg - Mercúrio
Mo - Molibdênio
Nd - Neomídio
Ne - Neônio
Np - Netúnio
Nb - Nióbio
Ni - Níquel
N - Nitrogênio
No - Nobélio
Os - Ósmio
Au - Ouro
O - Oxigênio
Pd - Paládio
Pt - Platina
Pu - Plutônio
Po - Polônio
K - Potássio
Pr - Praseomídio
Ag - Prata
Pm - Promécio
Pa - Protactínio
Ra - Rádio
Rn - Radônio
Re - Rênio
Rh - Ródio
Rb - Rubídio
Ru - Rutênio
Rf - Rutherfórdio
Sm - Samário
Se - Selênio
Si - Silício
Na - Sódio
Tl - Tálio
Ta - Tântalo
Tc - Tecnécio
Te - Telúrio
Tb - Térbio
Ti - Titânio
Th - Tório
Tm - Túlio
W - Tungstênio
U - Urânio
V - Vanádio
Xe - Xenônio
Zn - Zinco
Zr - Zircônio
